张旭东副教授团队在光热肿瘤免疫治疗研究方面取得进展
近日,国际纳米材料领域顶级期刊ACS Nano (IF:13.70)在线发表我院张旭东副教授团队在二维材料黑磷介导的个体化光热肿瘤免疫治疗方面的研究成果。题目为“Surgical Tumor-Derived Personalized Photothermal Vaccine Formulation for Cancer Immunotherapy”(DOI: 10.1021/acsnano.8b07371)。该论文的共同第一作者为清华大学硕士研究生叶鑫宇和中山大学药学院 (深圳) 研究员梁欣。中山大学医学院张旭东副教授和中山大学药学院(深圳)梅林教授为论文的共同通讯作者。全文链接:https://pubs.acs.org.ccindex.cn/doi/pdf/10.1021/acsnano.8b07371
手术切除是临床上肿瘤治疗的主要手段之一。然而,术后残留的微小肿瘤组织和血液循环肿瘤细胞会导致肿瘤复发或转移,成为肿瘤治疗面临的重大挑战。手术切除的肿瘤组织含有个体特异性的肿瘤抗原,特别是含有氨基酸突变的新抗原(Neoantigen),成为制备个体化肿瘤疫苗最好的材料来源。该研究团队利用手术切除的小鼠肿瘤组织和新型二维材料黑磷量子点(BPQDs)制备具有光热效应的纳米肿瘤疫苗(BPQD-CCNVs)。将纳米肿瘤疫苗、集落刺激因子(GM-CSF)和细菌脂多糖LPS共同装载到热敏水凝胶中,从而制备成个性化光热肿瘤疫苗复合物(Gel-BPQD-CCNVs)。皮下注射的热敏水凝胶将持续释放纳米疫苗。同时,在近红外光照下,黑磷量子点产生光热效应、联合GM-CSF和LPS招募并激活抗原递呈细胞如树突状细胞(DCs),从而捕获肿瘤抗原并激活肿瘤特异性T细胞。此外,联合T细胞免疫检查点抗体aPD-1阻断PD-1/PD-L1免疫检查点通路,增强T细胞抗肿瘤免疫应答效应,在小鼠乳腺癌和黑色素瘤模型中有效的抑制了术后肿瘤的复发和转移(图1)。
上述研究工作得到了国家自然科学基金项目、广东省杰出青年科学基金项目、深圳市科创委项目等经费的资助。
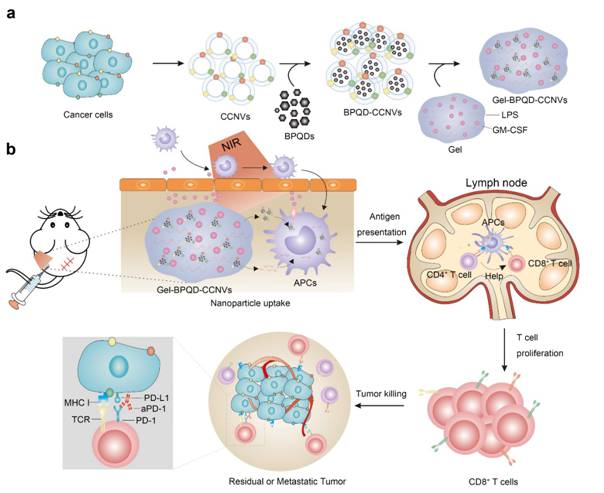
图1. Gel-BPQD-CCNVs和aPD-1介导的光热肿瘤免疫治疗示意图




