Nat Commun | 中山大学医学院赵博教授团队协同北京大学等单位共同揭示髓系细胞中TGF-β1的呈递与激活机制
2022年8月25日,中山大学医学院赵博教授课题组与北京大学等单位共同合作在Nature Communications杂志上发表题为“Specificity of TGF-β1 signal designated by LRRC33 and integrin αVβ8”的研究论文。该研究工作得到了国家重点研发计划重点专项、国家自然科学基金面上项目、广东省“珠江人才计划”、深圳市自然科学基金、启东产业创新基金、李革-赵宁生命科学青年研究基金等经费资助。中山大学医学院为该论文第二完成单位。北京大学生命科学学院张哲研究员、中山大学医学院赵博教授和深圳湾实验室转化医学中心王建船研究员为本论文共同通讯作者。北京大学生命科学学院2022届毕业生段泽林博士与中山大学医学院博士研究生林雪珍、王丽霞为本论文共同第一作者。
该项工作综合运用多种研究手段,揭示了髓系细胞中LRRC33(Leucine-Rich Repeat-Containing Protein 33)蛋白和整合素αVβ8蛋白呈递和激活L-TGF-β1 (latent transforming growth factor β)的分子机制,首次从分子层面证实了锚定蛋白对L-TGF-β不同亚型的选择特异性,并为进一步理解TGF-β1的功能和针对相关疾病的药物研发奠定了重要的理论基础。
转化生长因子β(TGF-β)是一类多效性细胞因子,在细胞增殖、分化、免疫调节及维持机体稳态等方面具有重要的作用。相应的,TGF-β信号通路的异常与多种疾病的发生发展密切相关,如癌症、纤维化和神经退行性疾病等。
TGF-β最初以一种非活性的前体形式被合成和分泌 (L-TGF-β1)。同时,在分泌过程中进一步与几种锚定蛋白(anchor protein)相结合。这些锚定蛋白具有不同的细胞和组织定位,从而协同调控TGF-β的分布和活性。L-TGF-β的激活方式多样,其中最主要的方式是由整合素αVβ6和αVβ8介导。TGF-β包括三种不同的亚型:TGF-β1、TGF-β2和TGF-β3。尽管三者的序列和结构同源性很高,并利用相同的受体激活下游信号通路,但是它们的生物学功能却有部分差别,这其中具体的机制并不明确。鉴于锚定蛋白和整合素对L-TGF-β呈递和激活的核心作用,人们推测它们的组织分布和对TGF-β的识别特性可能是决定TGF-β不同亚型功能异质性的原因。
该文章聚焦于探索髓系细胞(myeloid lineage cells)中L-TGF-β1的锚定和激活机制。作者利用单颗粒冷冻电镜技术,解析了人源L-TGF-β1/LRRC33二元复合物和整合素αVβ8/L-TGF-β1/LRRC33三元复合物的结构。通过结构分析和功能实验验证,作者发现L-TGF-β1/LRRC33中的非共价相互作用界面对复合物的形成至关重要,并且该区域中不同TGF-β亚型的序列差异,决定了LRRC33仅识别和呈递L-TGF-β1,而不呈递L-TGF-β2和-β3。此外,作者还阐明了整合素αVβ8通过2:2的结合模式激活L-TGF-β1的新型机制,并揭示了不同整合素(αVβ6和αVβ8)对L-TGF-β1亲和力存在巨大差异的结构基础(图1)。
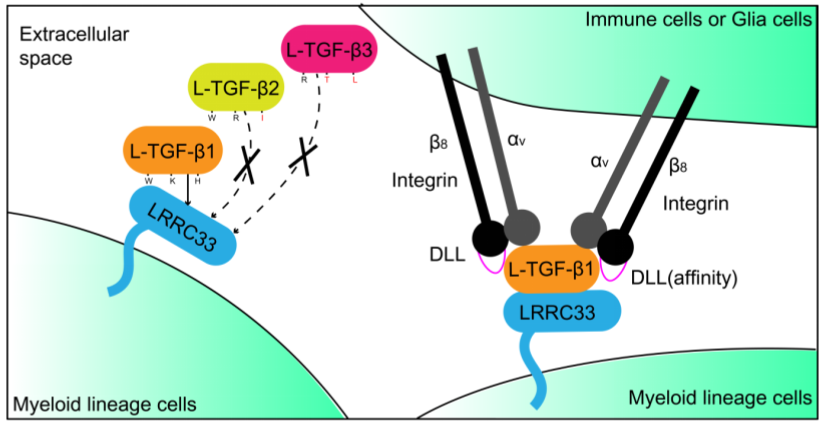
图1. 髓系细胞中TGF-β1的呈递和激活模型。锚定蛋白LRRC33特异性识别和呈递L-TGF-β1到髓系细胞表面,而非L-TGF-β2和L-TGF-β3(不同TGF-β亚型中介导与LRRC33蛋白相互识别的关键氨基酸残基被标出,黑色表示不同亚型间保守的氨基酸残基,红色表示不保守)。相邻细胞表面的整合素αVβ8蛋白通过2:2的结合模式高效激活被LRRC33呈递在细胞表面的L-TGF-β1,释放其中成熟的TGF-β1生长因子。β亚基DLL区域的序列特异性是不同类型整合素(αVβ6和αVβ8)对L-TGF-β1亲和力差异的决定因素。
赵博课题组介绍:
赵博:
中山大学医学院,“百人计划”引进人才,教授,博士生导师,免疫教研室主任,广东省“珠江人才”青年拔尖人才,深圳市孔雀计划海外高层次人才
课题组研究方向:
TGF-β(转化生长因子β)调节生命体在全生命周期的多种关键生理功能,在肿瘤与纤维化等重大疾病的发生发展中发挥关键作用。传统研究局限于TGF-β信号通路的下游,即成熟生长因子与受体结合以及胞内信号通路。本课题组的研究另辟蹊径,聚焦于TGF-β信号通路的上游,TGF-β以非活性前体pro-TGF-β的形式合成、分泌并储存在胞外。pro-TGF-β需经一系列胞外蛋白的精密调控,被定位到特定的微环境中,并以特定的方式激活,从而发挥出特定的功能。生长因子前体的激活与胞外调控是TGF-β家族生长因子信号通路发挥特异性功能的最关键步骤。
赵博教授对TGF-β家族代表性生长因子TGF-β1前体的生物合成、非活性机理及其由整合素介导的特异性激活机制进行了深入研究,取得了一系列突破性进展,成果发表在《Nature》、《Nature Communications》、《PNAS》等国际顶级学术期刊上。
主要研究方向:
1.TGF-β三种亚型β1、β2、β3不同的前体激活机制;
2.TGF-β不同亚型在不同组织微环境中的特异性提呈机制;
3.TGF-β超家族中异源二聚体的形成以及功能差异机制(聚焦超家族成员Inhibin/Activin);
4.TGF-β超家族生长因子结合细胞表面III型、II型受体的不同机制;
5.针对TGF-β生长因子的胞外调控步骤,设计和筛选针对肿瘤以及纤维化等重大疾病的新型治疗性抗体。




