我院皮荣标教授团队报道一种新的散发性AD模型并阐明其机制
阿尔茨海默病(Alzhermer disease,AD)是一种最常见的中枢神经系统退行性疾病。预计2050年全球患者将超1亿,其中90%为散发性AD患者。当前,抗AD药物临床试验频频失败,其原因之一可能是临床前研究阶段选用的动物模型不能很好模拟AD,尤其是散发性AD。因此,建立良好的散发性AD动物模型对于AD发病机制研究及新药开发尤其重要[1]。丙烯醛是一种结构简单的α,β-不饱和醛,既可以来自脂质代谢和多胺的代谢,也可以来自食物和环境。该团队前期发现,连续给予8周丙烯醛后SD大鼠表现出轻度认知障碍的病理特征[2],并且连续给予C57BL/6小鼠丙烯醛8周成功建立了散发性AD的早期病理特征[3]。通过对体内的丙烯醛结合蛋白质组学与体外RNA-seq进行分析,该团队发现丙烯醛主要加合到14-3-3蛋白和小GTPase蛋白家族,激活了RhoA/ROCK2通路[4]。
2022年3月22日,我院皮荣标教授团队联合中山医学院银巍副教授与山东中医药大学姚琳教授及其团队,在知名学术期刊Aging Cell 上发表了题为Arolein, an endogenous aldehyde induces synaptic dysfunction in vitro and in vivo: Involvement of RhoA/ROCK2 pathway的文章。研究团队在体内外系统地研究了丙烯醛对突触损伤作用,并发现ROCK的抑制剂法舒地尔或敲低ROCK2可以改善丙烯醛诱导的认知障碍和突触损伤,表明丙烯醛介导的AD突触损伤作用是通过激活ROCK2信号通路实现的。
该研究团队首先以原代神经元为对象,发现丙烯醛在体外能诱导Aβ和p-Tau蛋白表达增加。通过模拟AD病人脑内的丙烯醛浓度发现,病理状态下浓度的丙烯醛并不会使神经元死亡,但触发神经元突触断裂,同时下调突触相关蛋白水平。在体内实验中,研究团队同样发现丙烯醛可以升高小鼠脑中Aβ和p-Tau蛋白的水平,同时减少小鼠皮层神经元树突棘数目并下调突触相关蛋白表达。结合RNA-seq与之前的丙烯醛加合蛋白的结果,该团队将关键蛋白锁定在ROCK2上。在随后的体内、外实验中都证实,丙烯醛可以激活RhoA/ROCK2通路。在此基础上,该团队利用药理学方法和基因修饰小鼠,发现ROCK抑制剂法舒地尔或敲低ROCK2都能够减轻丙烯醛诱导的突触损伤和认知障碍,证实ROCK2参与了丙烯醛诱导的AD病理改变。
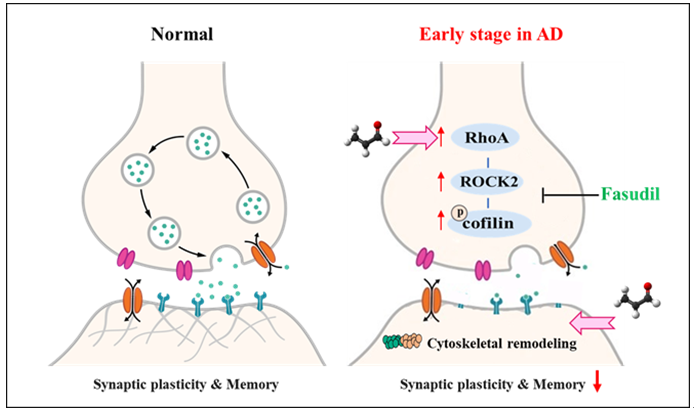
本研究首次揭示了丙烯醛造成早期AD病理特征及突触损伤的作用机制,进一步证实了丙烯醛模型作为散发性AD模型的可靠性。该研究还证明了ROCK抑制剂法舒地尔治疗AD的潜力。丙烯醛诱导的散发性AD模型将助力AD的发病机制研究和抗AD新药评价。
我中山大学医学院皮荣标教授、中山医学院银巍副教授与山东中医药大学姚琳教授为本文的共同通讯作者,朱泽宇博士和鲁俊锋博士为共同第一作者。该研究还得到中山医学院信文君教授团队的大力支持。该研究得到了国家自然科学基金动物模型专项资助(№81671264)。
相关文章链接:
1、https://onlinelibrary.wiley.com/doi/10.1002/med.21624
2、https://www.sciencedirect.com/science/article/pii/S0378427412014610?via%3Dihub
3、https://www.sciencedirect.com/science/article/pii/S1043661821005879?via%3Dihub
4、https://www.sciencedirect.com/science/article/pii/S0378427421000710?via%3Dihub
5. https://onlinelibrary.wiley.com/doi/epdf/10.1111/acel.13587
皮荣标教授简介:中国药理学学会会员、中国药理学神经精神药理学专业委员会委员、广东省药理学会理事、广东省药理学神经精神药理学专业委员会常务理事、中国神经科学学会会员和广东省“千百十”人才校级培养对象。主持国家自然科学基金与香港研究资助局联合项目、国家自然科学基金(3项)等项目10余项。近年在Aging Cell、Pharmacol Res、Mol Neurobiol、J Biol Chem、Eur J Med Chem、Br J Pharmacol、J Neurochem及Toxicol Lett等杂志发表论文100余篇。论文他引次数3000余次,H指数33。申请中国国家发明专利15项,授权11项;美国专利1项。http://szmed.sysu.edu.cn/zh-hans/node/1026。




